Bài viết này, Fivevet giúp bạn hiểu rõ hiệu quả PCR (PCR efficiency), cách đọc biểu đồ chuẩn real-time PCR, ý nghĩa Ct, slope, E% và ứng dụng trong định lượng DNA chính xác.

I. Real-time PCR là gì?
Trong kỹ thuật PCR, sau khi quá trình khuếch đại đoạn DNA đích hoàn tất, người làm thí nghiệm cần tiến hành thêm một số bước để đọc và phân tích kết quả, nhằm xác định xem trong ống phản ứng có tạo ra sản phẩm khuếch đại mong muốn hay không. Giai đoạn này được gọi là giai đoạn thí nghiệm sau PCR.
Ở giai đoạn này, sản phẩm PCR thường được:
- Điện di trên gel agarose để quan sát sự xuất hiện của vạch DNA có kích thước mong muốn hay không.
- Hoặc lai với các đoạn dò đặc hiệu (trên màng, trên giếng hay phiến nhựa,…) nhằm kiểm tra trình tự của sản phẩm khuếch đại.
Kỹ thuật PCR đòi hỏi phải thực hiện các bước đọc và phân tích sau khi phản ứng khuếch đại kết thúc như trên hiện nay được gọi là PCR cổ điển (classical PCR).
Real-time PCR là kỹ thuật PCR cho phép theo dõi và ghi nhận kết quả khuếch đại DNA đích ngay trong quá trình phản ứng diễn ra, sau mỗi chu kỳ nhiệt. Chính đặc điểm này là cơ sở cho tên gọi “real-time”.
Do tín hiệu khuếch đại được hiển thị đồng thời với quá trình nhân bản DNA, người làm thí nghiệm không cần phải thực hiện thêm các thí nghiệm sau PCR để xác định sự hiện diện của sản phẩm khuếch đại đích. Kết quả cuối cùng của phản ứng được hiển thị ngay khi phản ứng khuếch đại kết thúc.
Như vậy, có thể hiểu real-time PCR là kỹ thuật nhân bản DNA đích trong ống nghiệm thành hàng tỷ bản sao thông qua các chu kỳ nhiệt, đồng thời cho phép quan sát và phân tích kết quả khuếch đại ngay trong thời gian phản ứng diễn ra.
II. Các vấn đề kỹ thuật cơ bản cần biết của real-time PCR
2.1. Biểu đồ khuếch đại của real-time PCR
Trong kỹ thuật real-time PCR, dạng hiển thị cơ bản cho phép người làm thí nghiệm theo dõi quá trình nhân bản DNA trong các ống phản ứng là biểu đồ khuếch đại (amplification graph).
Trên biểu đồ này:
- Trục tung (Y) biểu diễn cường độ huỳnh quang phát ra từ các ống phản ứng khi được kích thích bằng ánh sáng.
- Trục hoành (X) biểu diễn các chu kỳ nhiệt của phản ứng PCR.
Quan sát biểu đồ khuếch đại (biểu đồ 1), đối với mỗi ống phản ứng, trong những chu kỳ nhiệt đầu tiên, cường độ huỳnh quang ghi nhận được thường rất thấp và gần như không thay đổi, hiển thị bằng một đường thẳng nằm ngang. Giai đoạn này được gọi là giai đoạn tiềm phục (lag phase) hay giai đoạn ủ.
Trong giai đoạn này, mặc dù DNA đích đã bắt đầu được nhân bản, nhưng số lượng bản sao chưa đủ lớn để tạo ra tín hiệu huỳnh quang có cường độ vượt ngưỡng phát hiện của thiết bị.
Khi số lượng bản sao của DNA đích tăng lên đến một ngưỡng nhất định, tín hiệu huỳnh quang phát ra sẽ đủ mạnh để được máy ghi nhận. Trên biểu đồ, lúc này đường biểu diễn khuếch đại bắt đầu tăng lên rõ rệt. Cường độ huỳnh quang trong ống phản ứng từ lúc này trở đi sẽ tăng gấp đôi sau mỗi chu kỳ nhiệt do số lượng bản sao của DNA đích tăng gấp đôi sau mỗi chu kỳ. Giai đoạn này được gọi là giai đoạn lũy thừa của cường độ huỳnh quang (exponential phase) - lưu ý rằng đây là sự tăng trưởng lũy thừa của tín hiệu huỳnh quang, chứ không phải là giai đoạn tăng trưởng lũy thừa về số lượng bản sao của DNA đích.
Cường độ huỳnh quang trong ống phản ứng sẽ tăng trưởng đến một mức nào đó thì độ tăng trưởng sẽ chậm dần và đạt đến bình nguyên vì các bản sao của DNA đích. Do nguồn dNTP dần cạn kiệt, enzyme Taq polymerase không hoạt động hiệu quả nữa và nên sẽ không còn gia tăng số lượng theo cấp số 2 nữa. Khi đó, tốc độ tăng của tín hiệu huỳnh quang chậm dần và cuối cùng đạt đến trạng thái ổn định, tạo thành giai đoạn bình nguyên (plateau phase) trên biểu đồ.
Chu kỳ ngưỡng (Ct – Threshold Cycle)
Khi phân tích đường biểu diễn khuếch đại (amplification curve) của một ống phản ứng sau khi hoàn tất các chu kỳ nhiệt, một thông số đặc biệt quan trọng luôn được xác định, đó là chu kỳ ngưỡng (Ct – threshold cycle).
Ct là chu kỳ nhiệt, tại đó thiết bị real-time được tín hiệu huỳnh quang phát ra từ ống phản ứng bắt đầu vượt qua cường độ huỳnh quang nền.
Để xác định cường độ huỳnh quang nền, thiết bị real-time PCR thường:
- Cường độ tín hiệu huỳnh quang xuất hiện trong ống phản ứng trong một số chu kỳ đầu, gọi là các chu kỳ nền (basal cycles).
- Tính giá trị trung bình của các tín hiệu này làm cường độ huỳnh quang nền.
Đường thẳng ngang đi qua giá trị huỳnh quang nền được gọi là đường nền (baseline).
Chu kỳ ngưỡng (Ct) là trị số được xác định bằng số chu kỳ mà ở đó đường nền cắt được đường biển diễn khuếch đại. Do được xác định bằng phương pháp nội suy nên Ct thường là một số thập phân (ví dụ: Ct = 28,35), hiếm khi là số nguyên.
Ý nghĩa của Ct và mối liên hệ với lượng DNA ban đầu
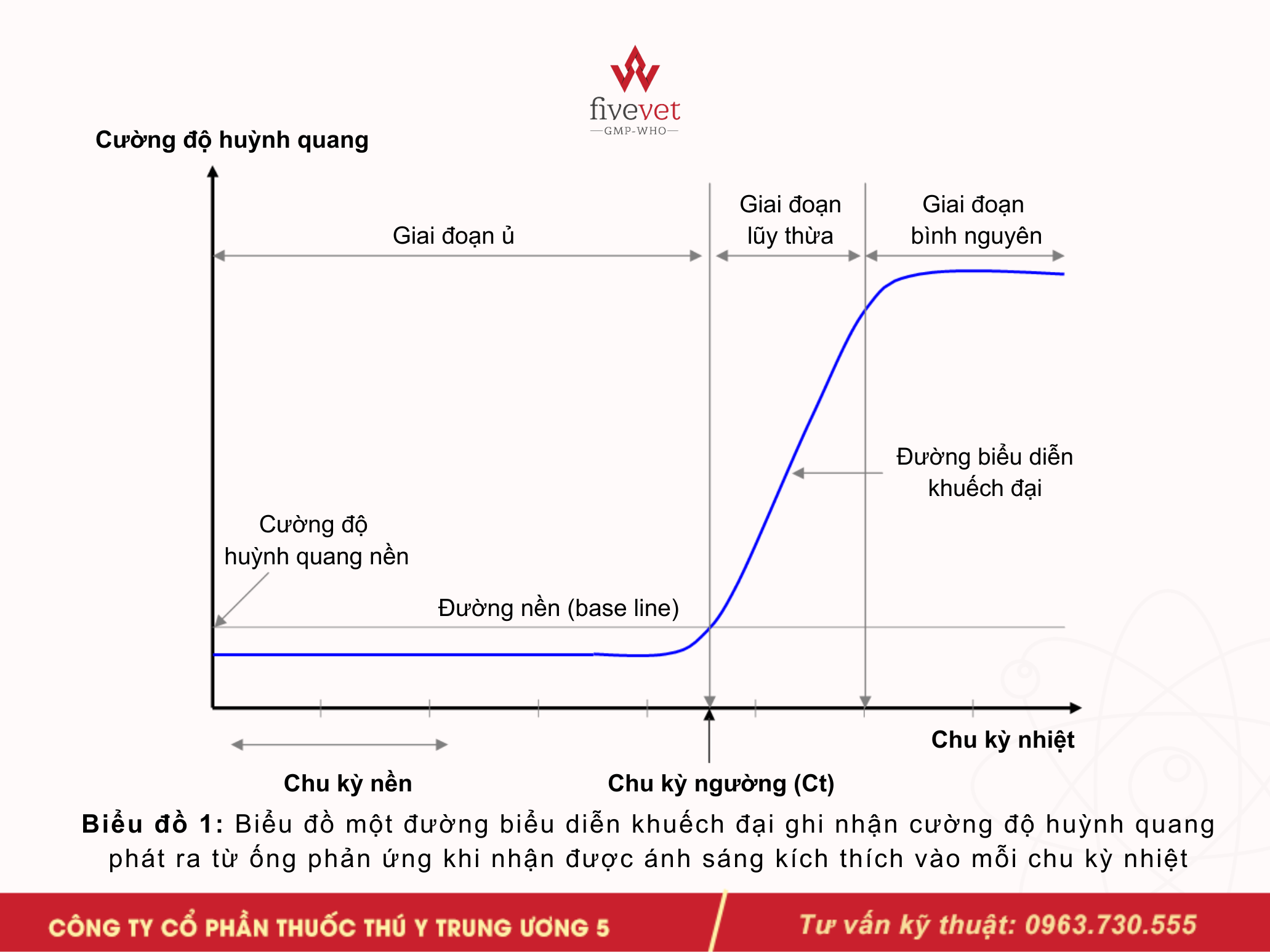
Biểu đồ 1: Biểu đồ một đường biểu diễn khuếch đại ghi nhận cường độ huỳnh quang phát ra từ ống phản ứng khi nhận được ánh sáng kích thích vào mỗi chu kỳ nhiệt
Trong thực tế, có những ống phản ứng cho Ct xuất hiện sớm, trong khi những ống khác lại có Ct muộn hơn. Nguyên nhân của sự khác biệt này là do số lượng DNA đích ban đầu trong mỗi ống phản ứng, còn gọi là (starting quantity,Sq).
- Sq càng lớn → cần ít chu kỳ nhiệt hơn để đạt ngưỡng tín hiệu huỳnh quang → Ct nhỏ (Ct sớm).
- Sq càng nhỏ → cần nhiều chu kỳ nhiệt hơn để đạt ngưỡng phát hiện → Ct lớn (Ct muộn).
Chính mối quan hệ nghịch này giữa Ct và lượng DNA ban đầu là cơ sở để real-time PCR được sử dụng rộng rãi trong định lượng DNA/RNA.
2.2. Biểu đồ chuẩn của real-time PCR
Chu kỳ ngưỡng (Ct) của một ống phản ứng real-time PCR xuất hiện sớm hay muộn (Ct thấp hay Ct cao) phụ thuộc trực tiếp vào số lượng bản DNA đích ban đầu (starting quantity – Sq) có trong ống phản ứng. Đây chính là ưu điểm vượt trội của real-time PCR so với PCR cổ điển, bởi nhờ mối liên hệ này, real-time PCR cho phép xác định chính xác số lượng bản sao DNA đích ban đầu trong mẫu thử, điều mà PCR cổ điển không thể thực hiện được một cách chính xác.
Trong PCR cổ điển, người làm thí nghiệm chỉ có thể đọc kết quả sau khi phản ứng khuếch đại kết thúc. Nếu có định lượng, thì đó cũng chỉ là định lượng số bản sao DNA đích sau khi PCR hoàn tất, chứ không phản ánh được chính xác số lượng DNA đích ban đầu. Nguyên nhân là do trong hầu hết các trường hợp, PCR cổ điển đã đạt đến giai đoạn bình nguyên, khi số lượng bản sao trong ống phản ứng đã đạt số lượng cực đại và không còn phản ánh mối liên hệ tuyến tính với lượng DNA ban đầu.
Để real-time PCR có thể định lượng chính xác số bản DNA đích ban đầu có trong mẫu thử, người làm thí nghiệm phải tiến hành phản ứng đồng thời:
- Mẫu thử chứa các số lượng bản DNA đích ban đầu cần xác định số lượng.
- Mẫu chuẩn chứa số lượng DNA đích ban đầu đã biết rõ số lượng.

Biểu đồ 2: Biểu đồ khuếch đại vẽ lên các đường biểu diễn khuếch đại của các mẫu thử và các mẫu chuẩn
Các mẫu chuẩn thường được chuẩn bị bằng cách pha loãng nối tiếp theo hệ số 10 (10-fold serial dilution) số lượng DNA đích ban đầu. Sau khi hoàn tất các chu kỳ nhiệt, trên biểu đồ khuếch đại (biểu đồ 2) , mỗi mẫu chuẩn và mỗi mẫu thử đều có một đường biểu diễn khuếch đại tương ứng và một giá trị Ct tương ứng.
Biểu đồ biểu diễn mối quan hệ giữa Ct và số lượng bản DNA đích ban đầu của các mẫu chuẩn được gọi là biểu đồ chuẩn (standard curve).

Biểu đồ 3: Biểu đồ chuẩn vẽ lên đường biểu diễn chuẩn về mối quan hệ giữa số lượng bản DNA đích có trong các mẫu chuẩn và chu kỳ ngưỡng tương ứng. Trong biểu đồ ở trên này, chúng ta E2-E4-E7 là các ống phản ứng chứa các mẫu chuẩn còn B4 là ống phản ứng chứa mẫu thử
Biểu đồ chuẩn là một đường thẳng tuyến tính, được xây dựng từ các điểm tọa độ xác định bởi:
- Trục tung (Y): chu kỳ ngưỡng Ct
- Trục hoành (X): số lượng bản DNA đích ban đầu có trong các mẫu chuẩn (log₁₀ Sq).
Do các mẫu chuẩn được pha loãng theo hệ số 10, nên trục X được biểu diễn dưới dạng log₁₀ số copies. Ví dụ:
 Số copies trong ống phản ứng
Số copies trong ống phản ứng
III. Các thông số quan trọng trên biểu đồ chuẩn
3.1. Hệ số tương quan R² (Coefficient of determination)
R² đánh giá độ tuyến tính của biểu đồ chuẩn, qua đó phản ánh độ chính xác của thao tác pipetting lấy có đúng thể tích mong muốn hay không, đặc biệt trong quá trình pha loãng mẫu chuẩn.
Trị số R² phải đạt từ 0,99 trở lên, điều này cho thấy đường biểu diễn chuẩn có độ tuyến tính cao. Nếu người làm thí nghiệm không hút đúng thể tích khi pipetting, thì lượng mẫu chuẩn đưa vào hỗn hợp real-time PCR sẽ không chính xác, dẫn đến đường chuẩn bị sai lệch và giá trị R² không thể đạt ≥ 0,99.
3.2. Hiệu quả PCR (PCR efficiency – E%)
Một thông số rất quan trọng khác mà người làm thí nghiệm cần nắm rõ là hiệu quả PCR, ký hiệu là E% (PCR efficiency). Khi phản ứng PCR đạt hiệu quả lý tưởng, thì sau mỗi chu kỳ nhiệt, cường độ huỳnh quang trong một ống phản ứng sẽ tăng gấp đôi. Nếu hai ống phản ứng có số lượng bản DNA đích ban đầu chênh lệch nhau theo một hệ số pha loãng là A, thì hai đường biểu diễn khuếch đại của chúng sẽ lệch nhau n chu kỳ nhiệt, với mối quan hệ A = 2ⁿ.
Như vậy, nếu hệ số pha loãng là 10 lần, thì chênh lệch Ct giữa các mẫu chuẩn liên tiếp sẽ là 3,32 chu kỳ (tính theo công thức trên với A = 10, suy ra n = 3,32). Trong biểu đồ chuẩn, khi các mẫu chuẩn được pha loãng theo hệ số 10, hiệu quả khuếch đại E được tính theo công thức:
E = 10⁻¹/ˢˡᵒᵖᵉ
Trong đó slope là độ dốc của đường biểu diễn chuẩn. Ở điều kiện lý tưởng, hiệu quả khuếch đại của PCR là E = 2, nghĩa là số lượng bản sao DNA đích tăng gấp đôi sau mỗi chu kỳ nhiệt trong giai đoạn tăng trưởng lũy thừa, tức là 2 = 10-1/slope. Từ công thức trên, ta tính được độ dốc lý tưởng của đường biểu diễn chuẩn là −3,32.
Như vậy, độ dốc của đường biểu diễn chuẩn phản ánh sự chênh lệch Ct giữa các mẫu chuẩn có số lượng DNA đích giảm dần theo hệ số pha loãng 10. Hiệu quả khuếch đại cũng có thể biểu diễn dưới dạng phần trăm theo công thức:
E% = (E − 1) × 100%
Với E = 2 thì E% = 100%. Đối với bất kỳ đường biểu diễn chuẩn nào, hiệu quả PCR đều có thể tính theo công thức:
E% = (10⁻¹/ˢˡᵒᵖᵉ − 1) × 100%
Ví dụ, nếu độ dốc của đường biểu diễn chuẩn là −3,436, thì hiệu quả khuếch đại sẽ là:
E = 10⁻¹/(−3,436) = 1,954
E% = (1,954 − 1) × 100% = 95,4%
Điều này có nghĩa là trong giai đoạn tăng trưởng lũy thừa, sau mỗi chu kỳ nhiệt, số lượng bản sao DNA đích tăng lên 1,954 lần, tương ứng với hiệu quả PCR là 95,4%. Trong thực tế, mặc dù hiệu quả PCR lý tưởng là 100%, nhưng hiệu quả PCR được chấp nhận nằm trong khoảng 90% – 105%.
Người làm thí nghiệm cần sử dụng giá trị hiệu quả PCR hiển thị trên biểu đồ chuẩn để đánh giá độ chính xác của thao tác pipetting trong quá trình pha loãng mẫu chuẩn. Một sai lầm thường gặp là mang theo DNA đích từ mẫu có nồng độ cao sang mẫu có nồng độ thấp, thường do không thay đầu pipette khi pha loãng, dẫn đến số lượng DNA đích trong các mẫu chuẩn cao hơn so với tính toán ban đầu.
Ví dụ, nếu thao tác đúng thì dãy pha loãng sẽ là 10.000 → 1.000 → 100 copies. Tuy nhiên, nếu không thay đầu pipette và lượng DNA kéo theo là 40%, thì dãy thực tế có thể trở thành 10.000 → 4.000 → 1.600 copies. Khi đó, Ct của các mẫu chuẩn sẽ gần nhau hơn, làm độ dốc của đường biểu diễn chuẩn giảm, dẫn đến hiệu quả PCR vượt quá 105%.
Ngược lại, nếu thao tác pha loãng không lấy đủ thể tích mẫu chuẩn từ ống có nồng độ cao (ví dụ do đầu pipette dính dung dịch, không đẩy hết mẫu), thì Ct của các mẫu chuẩn liên tiếp sẽ cách xa nhau hơn, làm độ dốc của đường biểu diễn chuẩn tăng và hiệu quả PCR giảm xuống dưới 95%.
Ngoài ra, hiệu quả PCR còn là thông số quan trọng giúp tối ưu hóa phản ứng real-time PCR. Nếu hiệu quả PCR thấp, nguyên nhân có thể do thiết kế mồi chưa tối ưu hoặc do tách chiết DNA đích còn các ức chế PCR. Ngược lại, nếu hiệu quả PCR quá cao, nguyên nhân có thể do bắt cặp không đặc hiệu của mồi hoặc đoạn dò.
Do đó, việc thiết lập biểu đồ chuẩn là bắt buộc trong real-time PCR định lượng, đặc biệt khi cần xác định chính xác số lượng tác nhân đích ban đầu trong mẫu thử. Trước hết, biểu đồ chuẩn giúp đánh giá độ chính xác của thao tác pipetting, yếu tố then chốt quyết định độ tin cậy của kết quả định lượng. Nếu thao tác pipetting không chính xác, thì không thể thu được kết quả định lượng chính xác.
Vì lý do này, sẽ là thiếu hợp lý nếu các bộ thuốc thử real-time PCR định lượng cung cấp sẵn các lại cung cấp sẵn các PCR mix có cho trước các lượng chuẩn của DNA đích mà không cho phép người làm thí nghiệm tự pha loãng, vì khi đó không thể kiểm soát được sai số thao tác.
Sau khi xác nhận thao tác pipetting đạt yêu cầu, người làm thí nghiệm sẽ sử dụng công dụng thứ hai của biểu đồ chuẩn để xác định số lượng tác nhân đích ban đầu trong mẫu thử. Việc tính toán này dựa trên phương trình biểu diễn mối quan hệ giữa Ct (Y) và log₁₀ số bản DNA đích ban đầu (X):
Y = [slope (X)] + intercept
Từ đó suy ra:
Sq = 10^[(Ct − intercept)/slope]
Giá trị Sq hiển thị trên máy được tính toán dựa trên công thức này. Từ số bản DNA đích trong ống phản ứng, người làm thí nghiệm sẽ tiếp tục quy đổi ra số lượng tác nhân đích trong mẫu ban đầu, dựa vào hiệu quả tách chiết nucleic acid và các hệ số pha loãng trong quá trình xử lý mẫu và thực hiện real-time PCR.
Ví dụ, khi sử dụng bộ thuốc thử định lượng HCV của công ty Nam Khoa, số copies HCV trong 1 ml huyết thanh bằng N×71, trong đó N là số copies đo được trong ống phản ứng. Tương tự, với bộ thuốc thử định lượng HBV, số copies HBV trong 1 ml huyết thanh bằng N×50
Câu hỏi thường gặp:
1. Hiệu quả PCR (E%) là gì?
Hiệu quả PCR (PCR efficiency – E%) là chỉ số cho biết mức độ nhân bản DNA đích sau mỗi chu kỳ nhiệt trong real-time PCR. Hiệu quả lý tưởng là 100%, nghĩa là số bản sao DNA đích tăng gấp đôi sau mỗi chu kỳ.
2. Hiệu quả PCR thấp (<90%) có thể do nguyên nhân gì?
Một số nguyên nhân thường gặp:
- Hút không đủ thể tích khi pha loãng
- Đầu pipette dính dung dịch, không đẩy hết mẫu
- DNA còn chất ức chế PCR
- Mồi thiết kế chưa tối ưu
3. Hiệu quả PCR quá cao (>105%) là do đâu?
Hiệu quả PCR cao bất thường thường do:
- Không thay đầu pipette khi pha loãng mẫu
- Mang DNA từ mẫu nồng độ cao sang mẫu nồng độ thấp
-> Làm Ct các mẫu chuẩn gần nhau hơn, khiến slope giảm và E% tăng.
4. Làm sao tính được số copies DNA đích từ Ct?
Số copies DNA đích được tính dựa trên phương trình đường chuẩn:
Ct = slope × log₁₀(Sq) + intercept
Suy ra: Sq = 10^[(Ct − intercept)/slope]
Máy real-time PCR tự động tính toán giá trị này dựa trên biểu đồ chuẩn.
5. Biểu đồ chuẩn dùng để làm gì trong real-time PCR?
Biểu đồ chuẩn có hai vai trò chính:
- Đánh giá độ chính xác của thao tác pipetting
- Tính toán số lượng DNA đích ban đầu trong mẫu thử
Xem thêm:
- Những điều cần lưu ý để đảm bảo chất lượng trong nuôi cấy tế bào
- Ứng dụng của tế bào Marc 145, BHK21, Vero
- Nghiên cứu sự biến đổi di truyền và độc lực của các chủng virus gây bệnh tiêu chảy cấp ở lợn do Porcine Epidemic Diarrhea Virus (PEDV)